Используемые в настоящее время методы профилактики и лечения животных с послеоперационными гнойно-воспалительными осложнениями (ПГВО) не всегда оказывают выраженное терапевтическое действие, недостаточны для локализации воспалительного процесса, подавления микрофлоры, попавшей при операции в рану, быстрого очищения раны от гнойно-некротических масс. Одним из существенных недостатков является однонаправленность терапевтического воздействия, сводящаяся, в основном, только к применению антимикробных препаратов, иногда осмотических и очень редко некролитических и не учитывается, в должной мере, влияние травмы, хирургической операции на факторы, определяющие характер течения раневого процесса и заживление ран. Между тем, успех лечения живот-ных оперативными методами во мно-гом зависит от характера течения, ди-намики развивающегося при операци-ях адаптационного синдрома, который является универсальной реакцией ор-ганизма на какое-либо повреждение или угрозу повреждения, затрагиваю-щий функции всех органов и систем [5,18,20].
Применяемый в данной работе комплекс мероприятий для профилак-тики и лечения ПГВО основан на уче-те динамики этого синдрома и коррек-ции неспецифической резистентности организма, воспалительной реакции. При этом учитывали, что каждая ста-дия такого синдрома характеризуется определенным комплексом изменений в нейроиммунноэндокринной системе. Так через шесть часов после стрессо-вого воздействия (в том числе опера-ции) развивается первая стадия стресса - реакция тревоги, которая длится 24-48 часов. Она характеризуется умень-шением тимуса, лейкоцитозом, появ-лением кровоизлияний и язв в слизи-стой желудочно-кишечного тракта. Со стороны эндокринной системы акти-вация адренокортикотропного гормона гипофиза, приводящая к увеличению секреции глюкортикоидов и угнете-нию минералокортикоидных гормонов [18]. Это приводит к быстрому выбро-су энергии в короткие сроки и переход на невыгодные пути биологического окисления [7]. Побочными продуктами этих процессов являются активиро-ванные формы кислорода - суперок-сидный анион-радикал О2-, гидро-ксильный радикал ОН-, перекись во-дорода Н2О2.
В обычных условиях эти ком-поненты не оказывают неблагоприят-ного воздействия на клетки. Однако избыточное образование их при стрес-се ведет к функциональным и струк-турным нарушениям клетки. Сущест-вует система обезвреживания этих ак-тивных форм О2: это ферменты - су-пероксиддисмутаза, пероксидазы, миелопероксидаза (МПО) и нефермен-тативные субстанции - глутатион, ви-тамин С, витамин Е, трансферрины, церулоплазмин и альбумин, гликопро-теиды (IgG, IgE, IgM, IgA) слизистых оболочек.
За стадией тревоги следует ста-дия резистентности, длительность ко-торой зависит от силы и продолжи-тельности стрессового воздействия (например, хирургической операции). Общие неспецифические адаптивные реакции организма формируются в этом периоде под руководством цен-тральной нервной системы автомати-чески. Важная роль здесь принадлежит гипоталамо-гипофизарной системе [14,15]. Под её влиянием формируется ряд факторов, отражающих степень негативного влияния стресса [6,7].
Первый фактор - повышение в клетке концентрации ионов кальция. Соединяясь с кальмодулином, он обра-зует форму, которая активирует боль-шинство протеинкиназ, необходимых для синтеза резистентных белков (пропердин, лизоцим, иммуноглобу-лины и др.).
Второй фактор - выброс гормо-нов стресса (катехоламинов, вазопрес-сина). Их влияние сказывается на ли-пидном обмене, что приводит к накоп-лению перекисных соединений и не-доокисленных продуктов высших жирных [8] кислот. Это явление необ-ходимо для активации клеток печени, сердца, скелетной мускулатуры. Одна-ко, длительное образование вышепе-речисленных продуктов приводит к нарушению клеточных мембран и вы-полняет роль ключевого патогенетиче-ского звена в развитии различных ос-ложнений (в том числе, при хирурги-ческом вмешательстве) [7].
Третий фактор - мобилизация энергетических ресурсов организма. Он сопровождается гипергликемией, увеличением концентрации жирных кислот, аминокислот, макроэргических соединений (аденозинтрифосфата, гуанозинтрифосфата, уридинтрифос-фата), а также мононуклеотидов. Это обеспечивает доступность для вклю-чения в биохимические процессы суб-стратов окисления, исходных продук-тов биосинтеза и создает необходимое энергетическое подкрепление этих процессов в тех органах, функцио-нальная активность которых наиболее необходима для обеспечения адапта-ции к возникшей ситуации [10]. Если с ней справиться не удается, то это при-водит к истощению организма.
Четвертый фактор - перерас-пределение ресурсов из неактивных систем в функциональную систему. Например, гиперемия в органах систе-мы, ответственной за адаптацию, при одновременном сужении сосудов в "неактивных" органах [5,6] (например, при лапаротомии возникает гиперемия в органах желудочно-кишечного трак-та, в тоже время в коже и в скелетной мускулатуре наблюдается анемия).
Пятый фактор - анаболический процесс, проявляющийся генерализо-ванной активацией синтеза нуклеино-вых кислот и белков в различных ор-ганах. Это обеспечивает выработку и фиксацию временных связей в голов-ном мозге, и ответ иммунокомпетент-ных органов на введение чужеродных антигенов. При затянувшейся во вре-мени стрессовой реакции или недоста-точной адаптации к ней, все рассмот-ренные выше адаптивные реакции трансформируются в повреждающие и могут стать патогенетической основой для возникновения и развития болез-ней [16], в том числен ПГВО [5].
Терапевтическую эффектив-ность комплекса мероприятий для профилактики и лечения животных с ПГВО [4] определяли на модели экс-периментальной лапаротомии у телят крупного рогатого скота. Для этого у 20 клинически здоровых телят крупно-го рогатого скота черно-пестрой поро-ды (из них 10 контрольных), подоб-ранных по принципу аналогов, в воз-расте от 8 до 10 месяцев, средней упи-танности выполнена лапаротомия. Животным опытной и контрольной групп проводили анестезию нервов брюшной стенки по Б.А.Башкирову и выполняли блокаду по В.В.Мосину. Операцию выполняли однотипно (па-ракостальный разрез длиной 17-18 см). Брюшную стенку в контрольной груп-пе зашивали трехэтажным швом. Пер-вые два этажа зашивали кетгутом (ам-пулированный), кожу - шелком (ампу-лированный). Длительность оператив-ного вмешательства составляла 23-25 минут. В контрольной группе поле операции готовили по Гроссиху-Филончикову, руки - по Альфельду, операционную рану присыпали пени-циллином (600000 ЕД). В послеопера-ционном периоде применяли пеницил-лин, выполняли блокаду по Мосину, внутривенно вводили глюкозу и хло-ристый кальций по общепринятой ме-тодике.
В подопытной группе операци-онное поле и руки хирурга готовили с помощью современных антисептиков: 0,5% раствором катапола [3] или это-ния [19]. Этими же растворами обиль-но промывали операционную рану пе-ред наложением шва, в том числе, ру-бец при руменотомии и матку при ке-саревом сечении. В качестве шва при-меняли съемный, проходящий через все слои брюшной стенки восьмиоб-разный шов, который снимали на 11-12 сутки после операции. Как в опыт-ной, так и в контрольной группах у пяти животных при снятии швов иссе-кали кусочки тканей раны и подвергали их гистологическому исследованию - по общепринятой методике [11]. За трое суток перед операцией внутри-мышечно каждому животному ежедневно вводили 10 мг тималина, под-кожно - 10 мл 5% аскорбиновой кислоты, а перед операцией внутривенно 100 мл 40% раствора глюкозы, 1 мл 2% раствора ксилазина. Антибиотики в подопытной группе не применяли. В послеоперационном периоде продол-жали введение тималина (начиная с третьего дня после операции), а также ежедневное введение аскорбиновой кислоты, глюкозы, хлористого каль-ция, выполняли блокады операцион-ной раны по Мосину.
Применяя витамин С, мы исхо-дили из того, что он необходим в окислительно-восстановительных про-цессах, в том числе для накопления АТФ (16). Он препятствует образова-нию перекисных соединений, стиму-лирует синтез катехоламинов в надпо-чечниках, что крайне важно для нор-мализации работы сердечно-сосудистой системы в условиях хирур-гического стресса. Кроме того, этот витамин необходим для синтеза колла-геновых волокон в тканях операцион-ной раны. Применение тималина свя-зано с тем, что клетки-мишени для этого препарата находятся в лимфоид-ной ткани, и что именно под его влия-нием происходит активация цикличе-ского аденозинмонофосфата, приводя-щая к активации синтеза иммуноком-петентных белков и продукции Т- и В- лимфоцитов [12]. Применение глюко-зы обусловлено необходимостью за-щиты центральной нервной системы, функции печени и других вегетатив-ных систем, синтеза витамина С, анти-токсической функции печени и обес-печении энергией в виде макроэргиче-ских соединений.
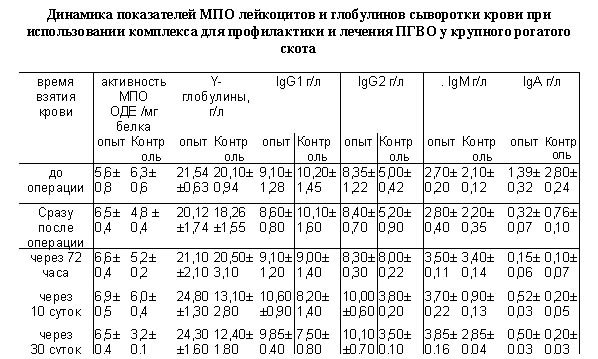
С целью анализа адаптивных процессов при операции у телят опре-деляли концентрацию общего белка по Кондрахину И.П (1985) концентрацию белков, адсорбирующихся на зимозане (БАЗ) по O.Gottze (1977). Концентра-цию иммуноглобулинов классов G1, G2, M, A определяли по Костиной М.А (1983), активность фермента миелопе-роксидазы (МПО) по С. Клебанову, 1967). Статистическую обработку по-лученных результатов проводили по Ойвину Н.А.(1960).
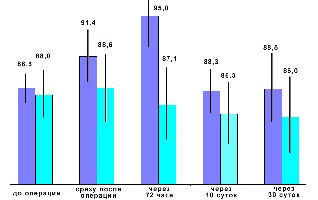
Результаты этих исследований представлены на рисунках и в таблице. Из них следует, что применение ком-плекса для профилактики ПГВО при-водит к повышению показателей, ре-зистентности организма в
 |
| Рис.1. Динамика концентрации общего белка сыво-ротки крови (светлый столбик - контроль, темный- опыт) |
При этом увеличение иммуног-лобулинов Ig1 составило 31% , IgМ - 35%, IgА - 72% на 30 сутки наблюде-ний, что существенно повышает ус-тойчивость к возбудителям инфекци-онных осложнений.
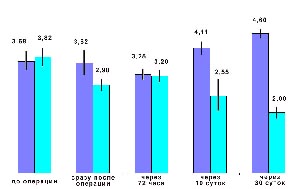 |
| Рис.2 Динамика концентрации белков, адсорбирую-щихся на зимозане (темный столбик - опыт, светлый - контроль) |
Сравнение показателей по ос-новному критерию эффективности ле-чебно-профилактических мероприятий при операциях - характере заживления ран и течению послеоперационного периода позволяет отметить сущест-венные различия в показателях между опытной и контрольной группами жи-вотных. Так, у животных контрольной группы отмечались выраженные при-знаки влияния хирургической агрессии в виде угнетения общего состояния, вялой реакции на внешние раздражи-тели, уменьшения или отсутствия ап-петита, вялой руминации и перисталь-тики кишечника, некоторым повыше-нием температуры тела (на 0,2-1,8°), тахикардией, лейкоцитозом. Эти при-знаки отмечали в той или иной мере в течение 4-8 суток послеоперационного периода. Кроме того, развивалось вы-раженное воспаление брюшной стен-ки, которое проявлялось в виде болез-ненности в области шва, припухлости, в двух случаях из десяти отмечали ПГВО в виде лигатурного свища, а в одном случае развился абсцесс и рас-хождение краев раны.
В подопытной группе использо-вание комплекса мероприятий для профилактики и лечения ПГВО позво-лило существенно снизить отрица-тельное влияние хирургической агрес-сии на организм животного, что про-являлось в более ранней (на 1-3 суток) нормализации общего состояния, пе-ристальтики кишечника, многогран-ных функций желудочно-кишечного тракта. У таких животных аппетит на-чинал восстанавливаться уже через несколько часов после операции, а на вторые сутки, как правило, наблюда-лась жвачка, нормализовывалась ру-минация, адекватная реакция на внеш-ние раздражения. Что касается темпе-ратуры тела, то следует отметить, что только у двух животных подопытной группы отмечалось её повышение вы-ше нормы на 0,5-1,2 градуса в течение двух суток, у остальных восьми жи-вотных она не выходила за пределы физиологических норм. Лейкоцитоз и эозинофилия отмечались в первые двое-трое суток у семи животных, и пять суток у остальных трех телят.
Что касается заживления опера-ционных ран, то следует отметить их гладкое заживление у девяти живот-ных, у одного теленка отмечали лига-турный свищ, который исчез через трое суток после снятия лигатуры. При этом клинические признаки воспали-тельной реакции в области шва также имели некоторое различие. Так, если у контрольных животных воспалитель-ный отек, припухлость и болезнен-ность продолжались в пределах пяти-девяти суток, то у контрольных в пре-делах трех-пяти суток. Обращает на себя внимание некоторая разница в гистологической картине в области шва. Если у контрольных животных при снятии швов к десятым суткам по-слеоперационного периода еще на-блюдаются очаги воспалительной ре-акции, а признаки регенерации (обра-зование коллагеновых волокон, нали-чие фибробластов) проявлялись в зна-чительно меньшей степени, чем у под-опытных животных. Клинически это наблюдалось в выраженном росте гра-нуляционной ткани (капилляров) у подопытных животных (при попытке разъединить края раны на третьи сутки после операции у всех животных в той или иной мере они кровоточили, что означало переход во вторую стадию послеоперационного адаптационного синдрома), в то время как у четырех контрольных животных кровотечение краев раны или отсутствовало или бы-ло незначительным, что свидетельст-вовало о слабом росте грануляционной ткани и наличии альтеративных про-цессов в тканях раны.
С целью определения эффек-тивности комплекса мероприятий по профилактике и лечению ПГВО в кли-нических условиях молочного ком-плекса проведено ряд операций по по-воду разного рода механических по-вреждений (резаных, рубленых, коло-тых ран различной локализации) а также при руменотомии, кесаревом сечении, грыжесечении у телят и дру-гих оперативных вмешательствах. Всего оперировано 50 животных. При этом ПГВО наблюдали у 3 животных (6%), из них 2 случая при руменото-мии, 1 случай при кесаревом сечении. Все животные выжили. В то же время, у 48 животных при использовании традиционных способов (с применени-ем традиционных антисептиков-5% спиртовой раствор йода, марганцово-кислого калия, антибиотиков, тради-ционную технику операций) ПГВО встречалось в 25% случаев (из них, 3 коровы были вынуждено убиты в свя-зи с неэффективностью лечебно-профилактических мероприятий (в том числе при кесаревом сечении из 18 ко-ров - 4 (22,2%), при руменотомии - из 16 - 4 животных (25%)). Обращает внимание тот факт, что чем раньше применялся комплекс мероприятий, тем выше была эффективность в от-ношении профилактики ПГВО. Эф-фективность лечения животных с ПГВО определялась степенью его тя-жести, возрастом, исходным состояни-ем нейроиммунноэндокринной систе-мы. Так, выполнение операции кесаре-во сечение у коровы с живым плодом в первые часы от начала родов приводи-ло во всех случаях (у 11 животных) к благоприятному исходу, заживлению ран по первичному натяжению. При операциях с мертвыми, разложивши-мися плодами (особенно при эмфиземе плода, выраженными признаками ин-токсикации), при наличии рваных ран в шейке матки и влагалище у рожени-цы, возникших в результате попыток извлечения плода, эффективность применения комплекса мероприятий была значительно меньшей, а лечение было продолжительным (до трех не-дель). При этом не удавалось избежать ПГВО, однако у всех животных, про-оперированных при таких тяжелых состояниях, оно носило локальный ха-рактер. В области шва осложнения не имели тенденции к генерализации. В то же время, при традиционном лече-нии ПГВО переходило к гнойному пе-ритониту, что приводило к вынужден-ному убою животных.
Применение комплексной про-филактики ПГВО при операциях у ко-шек и собак в условиях вет. станции (у 180 животных) позволяет также отме-тить его выраженную терапевтиче-скую эффективность при первичной хирургической обработке кусаных и рваных ран различной локализации, а также при удалении гнойной матки, остеосинтезе, грыжесечении, энтеро-томии, гастротомии и др. оперативных вмешательствах. Этим животным до-полнительно назначали мумие (0,1-0,2 г/сутки). В данных случаях ПГВО со-кратились на 10-28% по сравнению с животными контрольной группы (в зависимости от вида операции, исход-ного состояния организма, тяжести травмы, количества мертвых и нежиз-неспособных тканей, возраста, а также от условий содержания в послеопера-ционном периоде, особенно обеспече-ние покоя ране).
ПГВО, в случае возникновения, протекало более локально и доброка-чественнее, чем в контрольной группе. Экссудативные явления, как правило, прекращались в первые трое-четверо суток раневого процесса, после чего наблюдалось очищение раны, выра-женный рост грануляций, рубцевание и эпителизация.
В заключение можно отметить, что применение комплекса мероприя-тий для профилактики и лечения ПГВО, основанных на адекватной за-щите организма от хирургической аг-рессии (адекватная анестезия, приме-нение нейролептиков, иммунокоррек-ция (тималином), применение глюко-зы, аскорбиновой и др. витаминов) с учетом стадий развивающегося при операциях и других видах травм адап-тационного синдрома, тщательное со-блюдение техники операции, приме-нение поверхностно-активных анти-септиков (этония, катапола), адекват-ное дренирование, обеспечение покоя операционной ране и др. позволяет существенно снизить частоту возник-новения и развития ПГВО, а в случаях его возникновения локализовать его и придать ему доброкачественный ха-рактер.
Efficiency of a complex of pro-phylaxis and treatment for postoperative purulent inflammations (PPI) in domestic animals was studied. The biochemical re-searches and clinical examination were made in 50 calves and 180 dogs and cats. Concentrations of serum protein total, protein adsorbent on zymosan, immuno-globulins and activity of myeloperoxidase were determined. The complex of meas-ures for prophylaxis of PPI is based on adequate anesthesia, application of neu-roleptics, immunocorrectors and superfi-cial active antiseptics, sparing engineering of operations and rational postoperative treatment.